Sommaire de la page
Préparation des échantillons liquides
Les échantillons liquides traités au laboratoire sont des eaux naturelles (de rivière, souterraines, de pluie, d’infiltration de sol, eaux de mer...) ou des solutions de lessivage obtenues lors d'expérimentations faites au laboratoire. Après prélèvement sur le terrain, l’eau est soit filtrée sur place le jour même, soit retournée au laboratoire pour y être filtrée. Dans le cas de faibles volumes prélevés, la filtration est effectuée immédiatement avec des seringues de 60 mL en polypropylène et filtre en acétate de cellulose de porosité 0,45 µm. Pour des volumes importants de l’ordre du litre ou plus, l’eau est filtrée avec une unité de filtration en téflon d’un litre avec le même type de filtre. L’ensemble du matériel est préalablement nettoyé à l’acide ou/et à l’eau ultra-pure et conditionné entre chaque échantillon pour limiter la contamination et les pertes par adsorption.
Après filtration, l’échantillon est introduit dans un flacon en polypropylène. Il est ensuite acidifié à l'acide nitrique distillé et est stocké en chambre froide à une température de 4°C et à l’abri de la lumière.
Quartage et broyage des échantillons solides
Les échantillons solides traités au laboratoire peuvent être des roches, des minéraux, des sols, des sédiments de rivière, des poussières atmosphériques ou des matières en suspension collectées sur filtre, des végétaux, des coquilles calcaires, etc.
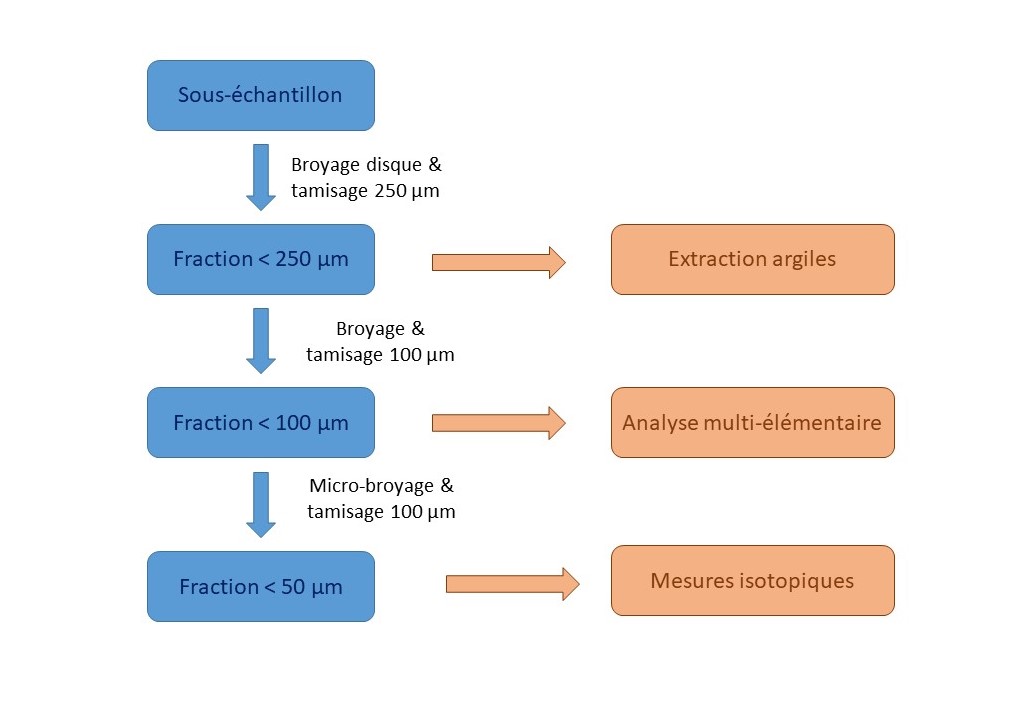
Après prélèvement sur le terrain, les solides sont retournés au laboratoire où ils seront séchés dans une étuve ventilée à une température de 30 à 60°C (30°C si l’on souhaite une bonne conservation de la matière organique). Après étuvage, les échantillons pourront, le cas échéant, être pulvérisés sous une presse hydraulique s’ils sont composés de blocs volumineux et durs et/ou être divisés en sous-échantillons par quartage et/ou être tamisés, ou triés manuellement. La méthode de quartage employée au laboratoire utilise un diviseur à rifles qui permet d’obtenir plusieurs sous-échantillons statistiquement identiques d’un point de vue granulométrique. Un des sous-échantillons sera ensuite broyé successivement:
- broyage avec disque d’agate (Retsch RS100) et tamisé en totalité à 250µm pour les échantillons grossiers. Une fois obtenue, cette poudre peut-être utilisée pour l'extraction des argiles (section Analyses minéralogiques DRX)
- une sous-fraction de ~20-30 g est ensuite broyée et tamisée à 100 µm
- la fraction inférieure à 100 µm est conservée pour la mesure des teneurs en éléments majeurs et traces (1-4g) et pour le banc gamma (~10 g)
- pour les analyses isotopiques, 5 g sont extraits de la poudre à 100 µm pour un micro-broyage final à l’aide d’un broyeur planétaire à billes d’agate avec tamisage total de la poudre à 50µm
Mise en solution des échantillons par attaque acide
Quelque soit la nature de l'échantillon, l'étape suivante est la dissolution de tous les éléments chimiques qui le constituent. Elle est réalisée en salle blanche.
- Les échantillons liquides, préalablement filtrés et acidifiés, sont évaporés dans des béchers en téflon. Le résidu de l’évaporation est ensuite décomposé par des acides oxydants comme HNO3, eau régale (mélange HNO3-HCl) ou encore H2O2/HClO4 qui permettent de détruire la matière organique et les phases colloïdales minérales comme les oxydes. Dans certains cas, l’acide fluorhydrique est également utilisé pour dissoudre les suspensions colloïdales silicatées très fines (<0,45µm) comme certaines argiles ou des gels de silice formés durant l’évaporation.
- Les échantillons solides (roches, sols, sediments silicatés) réduits en poudre fine (<50µm) sont solubilisés par une attaque acide oxydante. Ils sont décomposés et dissous également dans des béchers en téflon par l’action successive des mélanges HNO3-HF, HClO4 puis H3BO3-HCl à des températures comprises entre 70 et 200°C permettant d’atteindre une dissolution complète. Pour les minéraux réfractaires (zircons, titanites, monazites, etc…), les attaques acides se font sous pression dans des bombes en téflon et acier.
- Dans le cas particulier des végétaux, des attaques acides oxydantes en bécher en téflon sont réalisées avec des mélanges de HNO3, HCl, H2O2 et HClO4 jusqu’à dissolution totale. Ils peuvent aussi être solubilisés par un four à micro-ondes avec un mélange d’acide nitrique et chlorhydrique pour les faibles quantités (~100mg). Pour des quantités plus importantes, les végétaux sont d'abord calcinés dans un four à 500°C, puis les cendres obtenues sont dissoutes par attaque acide de la même manière que les roches.
- Pour certains éléments chimiques comme Si et B qui forment avec le fluor F des composés volatils, les échantillons sont solubilisés par fusion alcaline, permettant ainsi leur solubilisation sans la volatilisation du Si et du B. Dans ce cas, la poudre est mélangée avec un fondant (K2CO3, NaOH) et le mélange est porté à 1000°C dans un creuset en platine ce qui provoque sa fusion puis sa vitrification lors du refroidissement. La perle de verre est ensuite simplement dissoute par de l’acide nitrique.
Une fois l'échantillon dissous, il est évaporé à sec puis introduit dans de l'acide HNO3 dilué. Ensuite, il est possible de faire une analyse multi-élémentaire par ICP/AES ou ICP/MS ou de continuer la préparation de l'échantillon pour une mesure isotopique par TIMS ou MC-ICP-MS.
Chromatographie liquide préparative
Afin d'éviter les interférences lors d'une mesure isotopique, l’échantillon dissous doit être purifié. Les éléments chimiques le constituant sont séparés par chromatographie liquide sur des résines échangeuses d’ions générales (résines anioniques et cationiques Biorad AG1x8, AG50Wx8, AG50Wx12, AGMP1, TODGA©) ou très spécifiques (Sr-spec, TRU-spec et Ln-spec, Amberlite IRA 743). Cette purification a lieu en salle blanche, sous des hottes à flux laminaire de classe 100. Cette purification est réalisée par série de 10 à 17 colonnes. Pour chaque série sont inclus un blanc, des standards et des duplicatas avec les échantillons à analyser. Les acides des échantillons purifiés sont ensuite évaporés sur plaques chauffantes gainées de téflon dans des caissons étanches alimentés en air purifié (filtre absolu U15) et sous extraction. Ensuite, l'échantillon peut être préparé pour la mesure en fonction de l'instrument utilisé.
Préparation pour la mesure isotopique
Les deux appareils utilisés pour l’analyse des compositions isotopiques sont un Spectromètre de Masse à Thermo-Ionisation TIMS TRITON (ThermoScientific©), et un Spectromètre de Masse à source Plasma et à Multi-Collection MC-ICPMS NEPTUNE (ThermoScientific©). La différence principale entre ces deux appareils est la température d’ionisation des éléments de 1000 à 2000 °C pour le Triton et de 6000 à 8000 °C pour le Neptune. Ceci implique également une différence au niveau de l'introduction de l'échantillon pour la mesure. Pour le TIMS, l’échantillon est introduit en phase solide (sel) par dépôt sur un filament métallique et en phase liquide acide dans un plasma pour le MC-ICPMS.